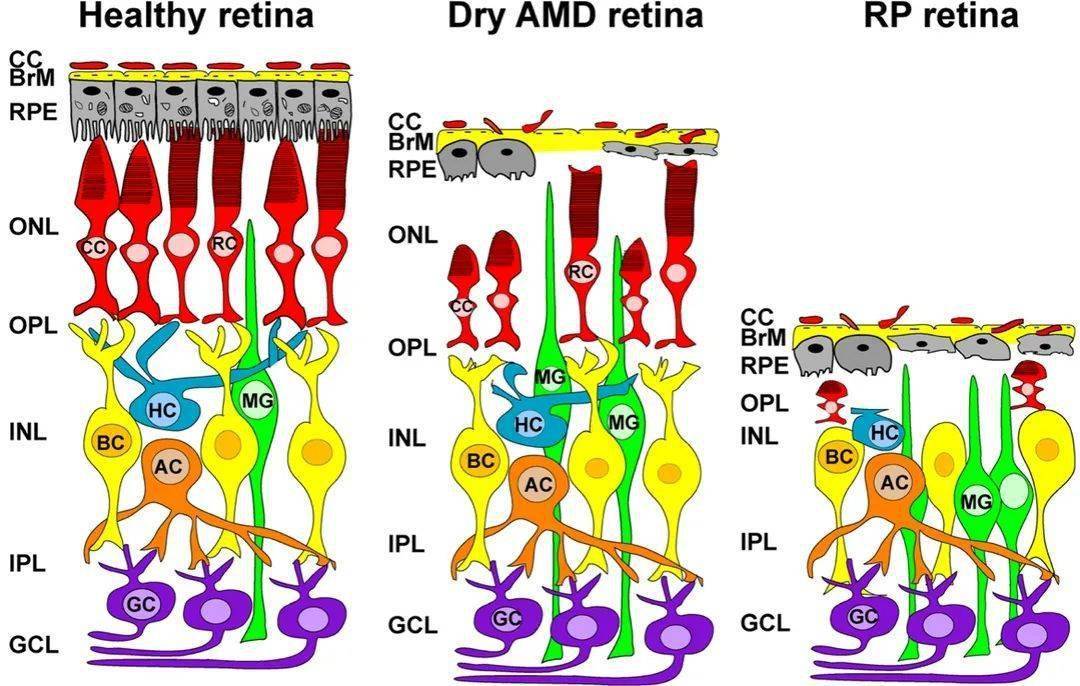
人类视网膜与大脑、脊髓共同组成中枢神经系统。视网膜发育起源于神经外胚层细胞,是位于眼内后段的精细且分层的神经组织。它由五种主要神经元类型组成:感光细胞(亦称光感受器细胞,包括视杆细胞和视锥细胞两种亚类),水平细胞,双极细胞,无长突细胞,视网膜神经节细胞和胶质细胞(Müller细胞)。视网膜由三个核层和两个突触层组成。视杆和视锥细胞的胞核形成外核层(ONL),水平细胞,双极细胞和无长突细胞的胞核形成内核层(INL),最内层的核层包含神经节细胞和少量星形胶质细胞,称为神经节细胞层(GCL)。
感光细胞在第一突触层即外丛状层(OPL)中与水平细胞和双极细胞形成突触。在第二个突触层,即内部丛状层(IPL)中,双极细胞和无长突细胞与神经节细胞发生突触连接。Müller细胞是跨越支撑视网膜的胶质细胞,支撑整个视网膜向上向后伸展。与感光细胞层相邻的是视网膜色素上皮(RPE)细胞,其顶端表面的微绒毛能不断吞噬并消化感光细胞受光氧化刺激所产生的外节膜盘,以维持感光细胞的正常功能。RPE的基底外侧面附着在Bruch膜(BrM)的下层,该膜将RPE与脉络膜毛细血管的内皮细胞分开。
视网膜是中枢神经系统(CNS)的光敏组织成分,多种细胞类型和复杂的结构是视网膜视力产生和维持必不可少的部分。视网膜本身是高度特化的初级神经元传感器细胞系统,它能接受外界环境中一定波长的光信号,转换成电信号后经视神经传到大脑视觉中枢,修饰分析形成视觉信息。


1
视网膜疾病的目前现状
都说“眼睛是心灵的窗户”,而眼内的视网膜被称为通往大脑的窗口。目前有超过200个的突变基因导致遗传性视网膜和黄斑疾病,视网膜变性疾病(如视网膜色素变性)和年龄相关性黄斑变性的光感受器丧失会导致视力的不可逆丧失,且目前临床上针对这些视网膜疾病仍缺乏有效的治疗方法,因此开发更有效的治疗方法和预防方法至关重要。
从早期的细胞生物学研究开始,眼睛(尤其是视网膜)引起了科学家的广泛兴趣。许多模型已被利用以阐明其发育、功能和发病机制。除了各种动物模型及人类临床和解剖学研究之外,基于干细胞的动物和人类细胞模型已经进入该领域。多能干细胞(PSC,包括胚胎干细胞ESC和诱导多能干细胞iPSC)可以分化为生物体的所有细胞,并且具有无限的分裂增殖能力。自首次成功分离和培养小鼠(1981)和人(1998)胚胎干细胞(ESC)以来,这些细胞被广泛用于体外各种细胞和组织类型的创建和研究。
然而,在大多数国家,由于伦理的限制,人ESC的使用仍受到较为严格的限制。且如果用于移植,很有可能会引起HLA的免疫排斥。与之相对应,iPSC是由完全分化的体细胞重编程为具有ESC相同特征(包括无限增殖,多能性基因的表达以及向三个胚层分化的能力)的干细胞。目前,人类视网膜中大多数与干细胞相关的研究都基于多能干细胞模型,虽然二维(2D)培养和分化的视网膜细胞揭示了其部分功能,但在许多方面已被三维(3D)结构(即视网膜类器官)取代。

2
类器官的定义
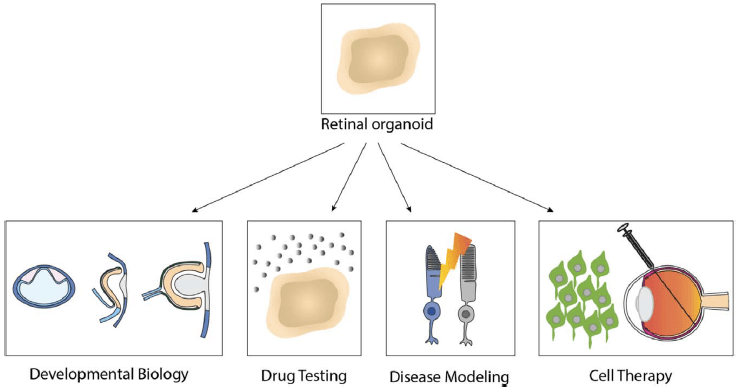
类器官是3D培养系统,由多个细胞和细胞类型在液体培养基或半液体基质中的悬浮生长,可用于模拟体内一些组织器官。iPSC可在一定条件下分化成为具有人类视网膜特征的3D视网膜类器官,不仅包含多种视网膜细胞(感光细胞、神经节细胞、RPE等),而且能形成与体内形态非常接近的明显分层。Yamanaka和Takahashi发现的iPSC为每位患者提供了自体iPSC建立的方法。即iPSC可来源于每个人的任何体细胞,这对于体外疾病模型建立提供了很大的帮助。
患者来源的iPSC分化得到的3D视网膜类器官提供了比大多数动物或其他模型更好地模拟人类疾病病理生理学的模型。其具有许多优势:(1)可用于研究体内视网膜的发育及疾病的发病机制;(2)可用于高通量药物的筛选;(3)可用于视网膜变性疾病特异性反应的临床前评估。
3
三维视网膜类器官的机遇
视网膜类器官的建立为视网膜疾病机制的研究和干细胞替代疗法提供了强有力的工具(Nakano et al., 2012)。近年来对人类视网膜类器官的分化又有了更高效率的改进创新(Pan et al., 2020)。
在疾病建模方面,视网膜色素变性(RP)的患病率约为1 / 4000,全世界大约共有150万患者。RPGR是编码感光细胞纤毛蛋白的基因,该基因的突变会导致视网膜色素变性。科学家们利用RPGR突变患者的iPSC分化得到的视网膜类器官显示出明显的纤毛受损和异常的感光细胞,以及许多与光转导相关的基因表达降低。且这些疾病表型通过基因编辑后得到了挽救。
视杆细胞cGMP-磷酸二酯酶6型β亚基(PDE6B) 编码的蛋白在cGMP水解中起重要作用,是光转导的关键部分。该基因的突变会导致感光细胞的功能受损。最近的研究中,研究者利用PDE6B突变患者建立了首个与晚发型RP表型一致的模型,观察到cGMP水平的升高和视杆细胞发育的缺陷,为PDE6B相关RP的相关机制提供了新的理论依据。(Gao et al., 2020; Behtaj et al., 2020; Brighi et al., 2020; Lidgerwood et al., 2019; Llonch et al., 2018; Singh et al., 2018; Deng et al., 2018)
利用患者特异性的视网膜细胞为个性化治疗药物的开发提供了新的途径。研究者们可以在患者来院的视网膜类器官或RPE上测试不同药物的效果,以找到最佳的治疗选择。此外,视网膜类器官还为药物测试提供了新的模型,任何新药的开发及应用都需要对其药效学进行分析和测试,还应包括对眼睛不良副作用的测试。
在干细胞替代疗法中,视网膜干细胞疗法是近年来最卓越的成果。眼睛具有简单的神经解剖学,而且由RPE和视网膜内部微脉管系统的内皮组成的血视网膜屏障(BRB)产生了免疫抑制环境,可有效减少移植排斥的风险。眼部空间易于移植,研究者们利用非侵入性方法便可轻松监测移植前后的组织状态。PSC来源的视网膜类器官/细胞,为视网膜移植提供了新的策略。在神经保护方面,一些临床试验已经开展了人类ESC衍生的RPE在黄斑变性中的应用,并且这项工作证明了移植物的安全性和生存性。使用PSC来源的细胞代替在神经退行性疾病中丢失的细胞,推动了干细胞在疾病建模和治疗中的治疗意义的研究(Jin et al., 2019; Hua et al., 2020)。
综上,PSC分化的视网膜类器官在疾病模型的构建,药物筛选及视网膜疾病替代疗法中具有非常大的应用价值。
4
类器官模型与最新技术的结合与应用
单细胞转录组测序和视网膜类器官作为两个生命科学的最近兴起的前沿方法学,有着高度的交叉,一起协同推动了神经领域的突破。高通量单细胞测序可用于研究视网膜类器官发育和分化的稳定性,解析视网膜的细胞类型组成、来源和分子特征等。
人体是一个由多组织和器官构成的复杂系统,常规的体外细胞培养方法很难准确地预测器官与组织之间的相互作用。微流体技术能在一定程度上模拟体内环境,该技术与人类干细胞衍生的细胞和类器官的结合被认为是目前和即将出现的药物测试或毒性筛查方面的先进工具。
单细胞测序分析,先进的微流体技术等方法有望大大扩展视网膜类器官在发育和疾病治疗中的应用。


部分参考文献(不全):
1. Behtaj, S., Öchsner, A., Anissimov, Y.G., Rybachuk, M., Retinal Tissue Bioengineering, Materials and Methods for the Treatment of Glaucoma. Tissue Eng. Regen. Med. 2020;173:253-269.
2. Brighi, C., Cordella, F., Chiriatti, L., Soloperto, A., Di Angelantonio, S., Retinal and Brain Organoids: Bridging the Gap Between in vivo Physiology and in vitro Micro-Physiology for the Study of Alzheimer’s Diseases. Front. Neurosci. 2020;14:655.
3. Deng, W.L., Gao, M.L., Lei, X.L., Lv, J.N., Zhao, H., He, K.W., Xia, X.X., Li, L.Y., Chen, Y.C., Li, Y.P., Pan, D., Xue, T., Jin, Z.B., Gene Correction Reverses Ciliopathy and Photoreceptor Loss in iPSC-Derived Retinal Organoids from Retinitis Pigmentosa Patients. Stem Cell Reports. 2018;10:1276-1281.
4. Gao, M.L., Lei, X.L., Han, F., He, K.W., Jin, S.Q., Zhang, Y.Y., Jin, Z.B., Patient-Specific Retinal Organoids Recapitulate Disease Features of Late-Onset Retinitis Pigmentosa. Front. Cell Dev. Biol. 2020;8:128.
5. Hua Z., Liu H., Wang N., Jin Z.B., Towards stem cell-based neuronal regeneration for glaucoma. Prog. Brain Res. 2020;in press.
6. Jin Z.B., Gao M.L., Deng W.L., Wu K.C., Sugita S., Mandai M., Takahashi M., Stemming retinal regeneration with pluripotent stem cells. Prog. Retin. Eye Res. 2019;69:38-56.
7. Lidgerwood, G.E., Hewitt, A.W., Pébay, A., Human pluripotent stem cells for the modelling of diseases of the retina and optic nerve: toward a retina in a dish. Curr. Opin. Pharmacol. 2019;48:114–119
8. Llonch, S., Carido, M., Ader, M., Organoid technology for retinal repair. Dev. Biol. 2018;433:132-143
9. Nakano T., Ando S., Takata N., Kawada M., Muguruma K., Sekiguchi K., Saito K., Yonemura S., Eiraku M., Sasai Y., Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 2012;10:771-785.
10. Pan D., Xia X.X., Zhou H., Jin S.Q., Lu Y.Y., Liu H., Gao M.L., Jin, Z.B., COCO enhances the efficiency of photoreceptor precursor differentiation in early human embryonic stem cell-derived retinal organoids. Stem Cell Res. Ther. 2020;11:366.
11. Singh, R., Cuzzani, O., Binette, F., Sternberg, H., West, M.D., Nasonkin, I.O., Pluripotent Stem Cells for Retinal Tissue Engineering: Current Status and Future Prospects. Stem Cell Rev. Rep. 2018;14:463–483.
《儿童青少年近视防控与干预 》
点击图书标题即可查看购买↑↑↑
内容简介
《儿童青少年近视防控与干预 》中山眼科曾骏文教授主审,王广勇先生、王海英教授、吕天斌主任主编.全是干货,实战案例诊断与处理……全书针对青少年视力问题,列举了将近50多个临床案例,更有针对性的解决青少年各种视力问题 , 通俗易懂 是视光人必备书籍!返回搜狐,查看更多

